华裔科学家张锋的新“基因剪刀”到底多厉害(组图)
本文转载自中国新闻周刊,仅代表原出处和原作者观点,仅供参考阅读,不代表本网态度和立场。
这项研究为基因编辑
提供一种新的备选方案
是该领域一项重要进步
日前,基因编辑领域备受瞩目的张锋团队在《自然》杂志发文称,在真核生物中首次发现了“基因剪刀”。张锋是美国麻省理工学院和哈佛大学博德研究所的核心成员之一,也是麻省理工学院麦戈文脑研究所的研究员。基因编辑可通过对基因组序列的精确修饰,为疾病治疗提供新的精准疗法。
张锋团队称,研究人员在真核生物中发现了第一个RNA引导的DNA切割酶——Fanzor蛋白,该蛋白质在真核生物中普遍存在。真核生物包括真菌、植物和动物。这也意味着,RNA引导的DNA切割机制存在于所有生命体中。更重要的是,这一新“剪刀”可以被优化,实现对人类基因组的编辑。
7月1日,美国国家科学院和工程院院士、哈佛医学院遗传学系教授乔治·丘奇接受《中国新闻周刊》采访时表示,Fanzor很难击败处于最好情况下的CRISPR/Cas9,后者基因编辑效率已经接近100%。不过,当处于最糟糕细胞类型和基因组位点组合的情况下,Fanzor存在击败CRISPR/Cas9的可能性。乔治·丘奇被誉为基因组学之父,获2016年诺贝尔化学奖提名,曾是张锋的博士后导师。

图/视觉中国
更多真核生物“基因剪刀”或被发现
如今最广泛使用的“基因剪刀”CRISPR/Cas存在于原核生物中,原核生物主要指细菌。2012年,法国科学家埃马纽尔·夏彭蒂耶和美国科学家詹妮弗·杜德纳在《科学》杂志发文并首次指出,CRISPR/Cas9系统在体外能“定点”对DNA切割,CRISPR在活细胞中有修改基因的能力。此后,科学家们一直想知道真核生物中是否存在类似系统,这也推动了Fanzor系统的发现。
CRISPR/Cas系统是原核生物的一种天然免疫系统。某些细菌遭到病毒入侵后,能够把病毒基因的一小段存储到自身DNA里,这一存储空间被称为CRISPR。病毒再次入侵时,细菌能根据存写的片段识别病毒,用“基因魔剪”将病毒的DNA切断。CRISPR,即成簇规律间隔短回文重复序列。Cas蛋白是一种核酸内切酶,对目的基因进行剪切,如Cas9和Cas12。目前,CRISPR/Cas9系统是研究最深入、技术最成熟、应用最广泛的类别。

张锋。图/博德研究所
2021年9月,张锋团队在《科学》杂志发表一项研究,重建了CRISPR/Cas9系统的进化起源。该研究在细菌中鉴定出一类新的核酸酶,属于RNA引导核酸酶,经过设计,可用于在人类细胞中编辑基因。这类新的核酸酶被命名为“OMEGA”,这其中包括一种名为TnpB的核酸酶。该研究推测TnpB或是Cas12的祖先。
张锋团队6月28日最新的研究表明,TnpB也可能是真核蛋白Fanzor的祖先,推测Fanzor酶也可能具有基因编辑能力。早在2013年,发表在《移动DNA》上的一篇研究指出,这两种蛋白有着某些共同点,并推测这些共同点对基因表达调控和天然化合物的合成,起至关重要的作用。
张锋团队的最新研究中,研究人员通过从真菌、藻类、变形虫等不同物种中分离出Fanzor蛋白,观察发现其与TnpB蛋白、Cas12有相似结构。研究人员认为,“紧凑的Fanzor系统”比CRISPR/Cas系统更容易用于特定细胞和组织。通过提高靶向效率,这些Fanzor系统可成为编辑人类基因组的工具。
上海科技大学生命科学与技术学院教授、基因编辑中心主任陈佳告诉《中国新闻周刊》,这项研究发现了目前广泛应用的CRISPR/Cas系统之外的一种新基因编辑系统。研究主要亮点在于,首次在真核生物中发现RNA介导的基因编辑系统,而真核细胞和人体细胞结构更接近。在陈佳看来,后续基因编辑的研究可能也会朝着这一方向开展。Fanzor属于真核生物中第一代“剪刀”,后续二代、三代应该也会很快被开发出来。
“这项研究为基因编辑提供一种新的备选方案,是该领域一项重要进步。”华中农大动物医学院教授张安定告诉《中国新闻周刊》,2012年在细菌中发现的CRISPR/Cas系统具有里程碑意义,相当于找到了细菌防御系统和新型基因编辑工具,张锋团队在其中也作出重要贡献。随后他们开始寻找防御系统的源头,现这一防御系统扩大到了真核生物,这是比较大的突破。
CRISPR/Cas9系统起作用的部分包括Cas9和负责在基因组上精确定位的向导RNA。通俗讲,Cas9和向导RNA就像一把“剪刀”和一把“尺子”,“尺子”负责在基因组上精准找到需要编辑的位置,“剪刀”对基因组剪切。完成目标基因的剪切编辑之后,“剪刀”和“尺子”都会被细胞完全清除掉。
任何一种基因编辑技术,靶位点的选择都是首要问题。在CRISPR/Cas9系统中,剪切点只有位于处于特定位置的PAM序列的上游,才能够被准确识别和切割。“Cas酶切割DNA需要找到PAM序列,Fanzor蛋白实现DNA切割,也需要找到一段特定的TAM序列。从这点来看,两者比较相似,因为切割偏好的序列不同,也存在序列互补性。”陈佳说。
能替代CRISPR/Cas“魔剪”吗?
前述最新研究中,研究人员发现,在所检测的4种Fanzor蛋白中,有3种蛋白对特定DNA序列编辑的效率达到11.8%。这一水平与早期版本CRISPR系统相当,但低于优化过后的CRISPR系统。之后,通过工程化技术,研究人员在Fanzor蛋白中引入了特定突变,使其活性增加约10倍。
陈佳告诉《中国新闻周刊》,从2012年CRISPR系统被发现至今,全球很多实验室在CRISPR/Cas系统的优化和改造方面投入巨大。即便在这项工作中Fanzor的编辑效率较其初始状态提高了10倍,但还是达不到CRISPR/Cas9目前的编辑效率。不过,Fanzor有其自身优势,与CRISPR蛋白不同,Fanzor本身源自真核系统,有可能在临床治疗中能避免非必要的免疫反应。目前,CRISPR/Cas9系统较成熟,Fanzor未来通过优化,也可能实现更精准高效的切割。
与某些CRISPR系统和TnpB蛋白不同,研究人员观察到,真菌衍生的Fanzor蛋白不表现出“附带活性”。附带活性是指当RNA引导的“剪刀”靶向切割DNA时,会同时降解邻近的DNA或RNA。因此,Fanzor蛋白被视为更具专一性。
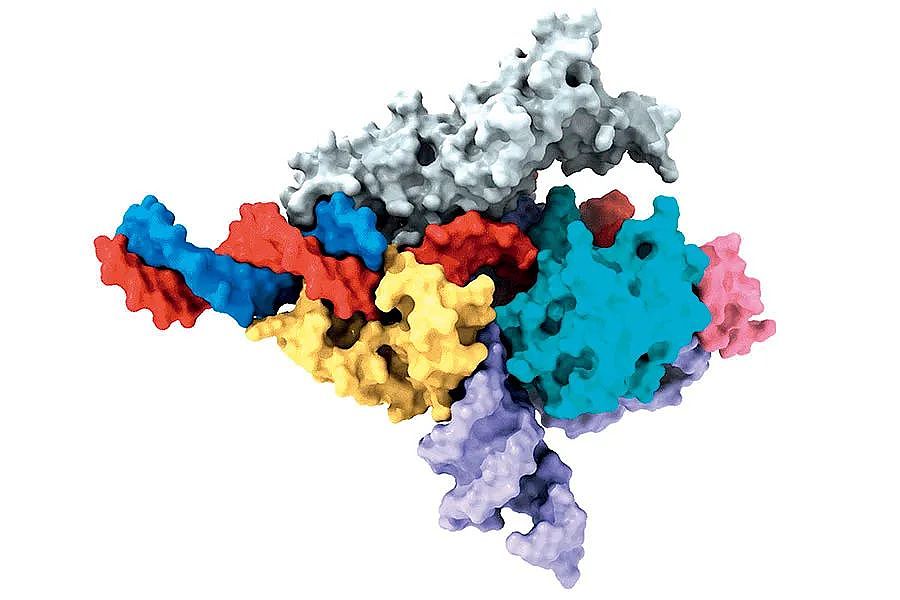
Fanzor蛋白冷冻电镜结构示意图。图/张锋实验室
近日,张锋接受外媒采访时表示,Fanzor蛋白的尺寸较小,含有400~700个氨基酸不等。CRISPR中最常用的Cas9蛋白约含1000~1600个氨基酸。“编辑器越大,递送到体内就越困难。”他说。据2021年9月张锋团队在《科学》杂志的研究,被称为“OMEGA”的一类核酸酶很小,约为Cas9的30%,它们可能更容易被递送到细胞中。
在陈佳看来,很多基因编辑系统在实验室水平效果不错,但进展到人体临床试验水平,编辑效率不一定高,出现这种问题的主要原因在于递送过程。在CRISPR系统对基因进行编辑时,需要通过载体将这些大蛋白递送到体内准确位置才能发挥作用。相较Cas9,Fanzor蛋白体积小,在递送过程中更灵活、便利。
在张安定看来,选择怎样的基因编辑工具,取决于实际应用的目的,基因编辑效率和脱靶是重要的考虑因素。虽然CRISPR/Cas系统已被广泛使用,但它并非“包打天下”,其在有些细胞中的效率并不高,且存在脱靶等安全隐患。Fanzor蛋白更小,可能在一定场景下使用时更有优势。“研究中没有提到Fanzor蛋白是否能避免潜在的脱靶等问题,但也可能和Cas一样,需要通过后续研究进一步提高基因编辑活性和减少潜在脱靶等问题。”他说。
“到目前为止,还没有出现超越CRISPR的技术。Fanzor想在应用上取代CRISPR/Cas系统,还有很长的路要走。”中国农业大学生物学院教授陈其军告诉《中国新闻周刊》,尽管Fanzor系统在基因治疗上存在递送药物优势,但如果编辑效率不高,靶点受太多限制,在医疗上的应用也很难超越CRISPR/Cas。
目前尚无CRISPR基因疗法获批
CRISPR基因编辑技术,无疑是目前生物技术领域最具革命性的突破之一。2020年,夏彭蒂耶和杜德纳因发现“基因剪刀”CRISPR/Cas9,共同获得当年的诺贝尔化学奖,获奖时距离这项技术被发明还不到10年。
张锋无缘诺奖,却赢了专利之争。2013年年初,张锋等人首次将CRISPR/Cas9技术成功应用于哺乳动物和人类细胞的基因编辑。同年,丘奇在《科学》杂志上发表的研究也显示,CRISPR系统可用于人类细胞基因组编辑。
这些进展极大推动了CRISPR/Cas9技术的推广和应用。自2013年起,张锋和前述两名诺奖获得者均基于该技术创立了多家公司。此后,张锋与杜德纳和夏彭蒂耶等人著名的专利权之争拉开序幕。
2022年2月,美国专利和商标局裁定,张锋团队拥有在真核细胞中使用CRISPR基因编辑技术的专利。这意味着,张锋和他所在的博德研究所在美国拥有CRISPR/Cas9技术应用于所有真核生物的专利,包括植物、动物和人类。这是CRISPR技术商业化最为核心的专利之一。
近年来,科学家们在CRISPR/Cas9治疗疾病领域持续探索。2020年,四川大学华西医院肿瘤科卢铀团队在《自然-医学》发布Ⅰ期临床试验结果,表明用使用CRISPR/Cas9技术治疗难治性非小细胞肺癌患者安全可行。
在陈佳看来,目前基因编辑治疗在地中海贫血症、镰刀贫血症等血液类遗传病治疗领域走得靠前,国内外已有几项关键性治疗管线进入临床阶段。此外,通用型CAR-T联合基因编辑疗法,目前研究进展也比较快。
2022年3月17日,国家药监局药品审评中心官网显示,南京北恒生物科技有限公司自主研发的细胞注射液产品获得国家药监局的临床试验默示许可。该产品属于通用型CAR-T,用于治疗成人复发或难治性B细胞急性淋巴细胞白血病,是国内首个基于CRISPR基因编辑技术的免疫细胞治疗产品。
丘奇告诉《中国新闻周刊》,Fanzor的商业前景和其他数百种内切酶相似。不过,Fanzor距离真正商业化应用,似乎还有很远。因为即便是已有不少临床研究进展的CRISPR/Cas技术,目前获批的相关基因疗法数目仍为0。
“迄今为止,已获美国食品和药物管理局(FDA)批准的基因疗法共有12种,均不涉及CRISPR。”丘奇表示,这种情况将在2023年12月8日改变,目前有一种CRISPR相关的基因疗法处于生物制剂许可申请(BLA)阶段。一般药物的Ⅲ期临床试验结束,被验证安全性、有效性之后,可以正式向FDA提交BLA申请。
6月8日,美国食品和药物管理局(FDA)宣布,接受名为exa-cel疗法的生物制品许可申请。该疗法由美国福泰制药与瑞士基因编辑公司CRISPR Therapeutics合作开发,用于治疗严重镰状细胞病和输血依赖性β地中海贫血,能够帮助患者有效摆脱输血和血管阻塞危机。美国福泰制药当日发表的新闻稿称,“这种疗法有望成为第一个获得批准的CRISPR基因编辑疗法。”CRISPR Therapeutics的创始人正是2020年凭借CRISPR基因编辑获得诺贝尔化学奖的夏彭蒂耶。
为何真正能走向获批的CRISPR基因疗法很少?丘奇解释,CRISPR主要用于“减法”,即对目标基因完成剪切、编辑。他表示,一般遗传性血管性水肿等显性疾病可以通过减少突变等位基因来治疗,但这种情况非常罕见。疾病治疗时通常需要“加法”,比如,所有的衰老基因疗法都是添加基因,很多情况下,疫苗制备要添加一个或多个外源基因。
“基因编辑的工具箱越大,可选方式越多,对科学研究和临床治疗的帮助就越大。”陈佳表示。在他看来,如果后续仅把Fanzor用作内切酶进行基因编辑治疗,也会面临和CRISPR/Cas9一样的风险;如果将Fanzor作为平台开发新型的碱基编辑器等,可能实现更安全的基因编辑治疗。
碱基编辑系统可以实现单核苷酸精度的DNA或RNA编辑。6月27日,中国科学院遗传与发育生物学研究所高彩霞等发表在《细胞》杂志的一项研究,运用AI辅助结构预测,开发了一系列新型碱基编辑工具,在小鼠细胞系中成功获得高达43.1%的编辑效率,解决了常规碱基编辑器过大而无法被递送的难题。
在丘奇看来,基于Fanzor系统的基因编辑疗法未来也可能会获FDA批准上市。“但许多天然存在或人工合成的新RNA可编程系统占比不大,相对应地,简单的添加性基因治疗方法正在迅速发展。”丘奇表示。
本文转载自中国新闻周刊,仅代表原出处和原作者观点,仅供参考阅读,不代表本网态度和立场。





 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


