揭开庐山真面目,李兰娟/李赛/施一公首次解析新冠病毒完整结构(组图)
新型冠状病毒(SARS-CoV-2)是导致目前COVID-19大流行的病原体,是一种新型的β冠状病毒。在全世界科学家的共同努力下,新冠病毒的蛋白结构阐明方面已取得了许多进展,目前已确定新冠病毒基因组编码29个蛋白,其中有四种为结构蛋白,分别是:刺突蛋白(S蛋白)、核衣壳蛋白(N蛋白)、膜蛋白(M蛋白)和包膜蛋白(E蛋白)。然而,完整的新冠病毒详细结构仍然有待揭示。
2020年9月14日,浙江大学传染病诊治国家重点实验室李兰娟院士、清华大学生科院李赛研究员合作在国际顶尖学术期刊Cell杂志发表了题为:Molecular architecture of the SARS-CoV-2 virus的研究论文。
该研究使用冷冻电子断层扫描(cryo-ET)和子断层扫描图平均化(STA),解析了真实的新冠病毒的分子组装。非常详细地描绘了新冠病毒的完整结构,揭示了新冠病毒是如何在直径仅80nm的内腔中堆积30kb长的RNA基因组。

约600 kDa的三聚S蛋白是已知的最大的I类融合蛋白之一,它被66个N-连接的聚糖高度糖基化。S蛋白通过受体结合域(RBD)与细胞表面受体血管紧张素转化酶2(ACE2)结合,从而入侵细胞。
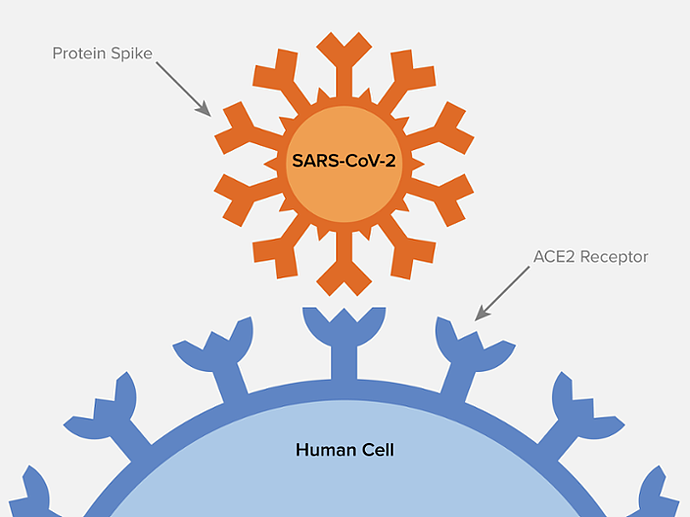
尽管研究人员已经通过重组蛋白在接近原子分辨率下解析了新冠病毒对宿主的识别和入侵机制,但我们仍需要真病毒高分辨率的原位结构信息。
冠状病毒拥有所有RNA病毒中最大的基因组。它的核衣壳蛋白(N蛋白)质如何在病毒中寡聚,组织和包装长达30kb的单链RNA,令人费解。
到目前为止,还没有针对冠状病毒的核糖核蛋白(RNP)的分子模型,对其他(+)RNA病毒的RNP结构、组装和RNA包装也知之甚少。
为了解决这些问题,研究团队结合了冷冻电子断层扫描(cryo-ET)和子断层扫描图平均化(STA)对从早期新冠病毒株繁殖的2294个完整病毒颗粒进行成像分析。
该研究确定了新冠病毒刺突蛋白(S蛋白)与宿主细胞ACE2蛋白融合前后的天然结构,平均分辨率为8.7-11 。通过质谱分析来自天然刺突的N-连接聚糖的组成,揭示了天然聚糖与重组糖蛋白聚糖的总体加工状态高度相似。该研究还解析了核糖核蛋白(RNP)的天然构象和高级结构,
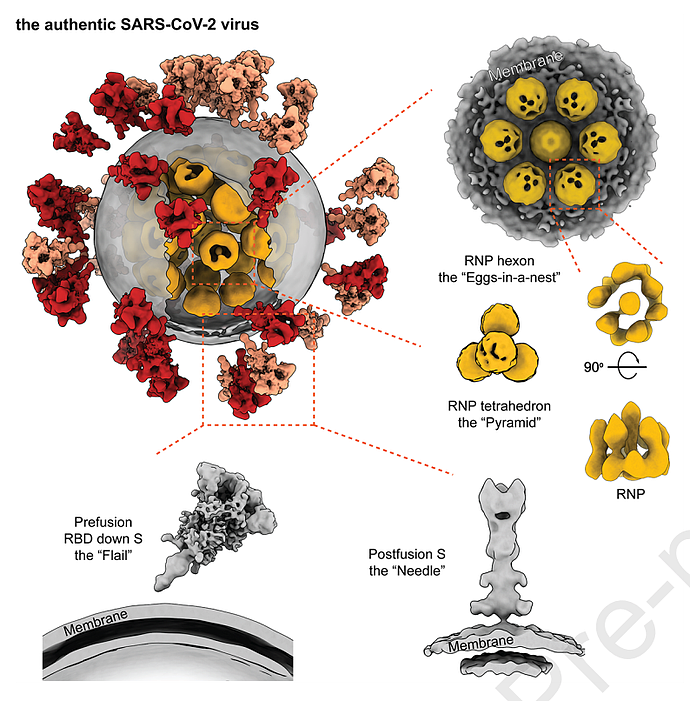
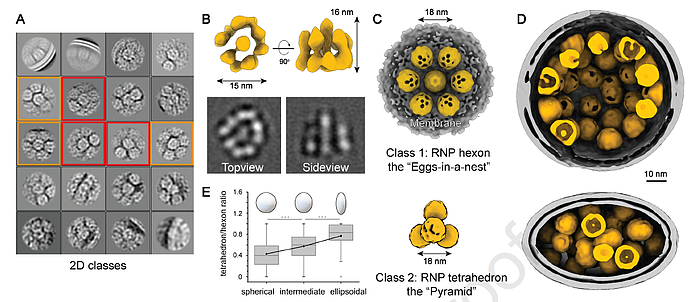
在2D层面,核糖核蛋白(RNP)有三种组合方式,分别是挨着胞膜蛋白包装、六边形、三角形。在3D层面,靠近膜的RNP形成了类似巢中蛋的六面体结构,无膜的RNP则形成金字塔型的四面体结构。大多数六面体来自球形病毒体,而更多的四面体来自椭球形病毒体。统计分析表明,椭球形病毒体往往会堆积更多的RNP四面体。
此外,四面体和六面体的两个相邻RNP之间的间距相同,均为18nm,并且某些四面体可组装成六面体,这表明RNP四面体是病毒关键且基本的包装单位。
该研究解析了真实的新冠病毒的分子组装,非常详细地描绘了新冠病毒的完整结构,揭示了新冠病毒是如何在直径仅80nm的内腔中堆积30kb长的RNA基因组。该研究构建了迄今为止新冠病毒最大的冷冻电子断层扫描(cryo-ET)数据集。也为将来的完整病毒分子动力学模拟、3D打印,以及教育或公共媒体提供了全新的模型。








 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


