中国官宣:法匹拉韦成功完成临床研究,4天就见效,即将批量生产!(组图)

科技部生物中心主任张新民回答记者提问。
新京报讯 3月17日,国务院联防联控机制召开发布会,介绍药物疫苗和检测试剂研发攻关最新情况。会上,科技部生物中心主任张新民介绍,法匹拉韦已完成临床研究,显示出很好的临床疗效。
在安全性方面,法匹拉韦已经于2014年在日本获批上市,上市以来未见明显的不良反应。在治疗新冠肺炎的临床研究中,未发现明显的不良反应。
在有效性方面,深圳市第三人民医院开展的法匹拉韦联合干扰素治疗新冠肺炎有效性和安全性研究,入组患者80例,其中法匹拉韦组35例,对照组45例。研究结果显示,在病毒核酸转阴方面,法匹拉韦治疗组治疗后患者病毒核酸转阴与对照组相比,转阴时间中位值明显缩短,分别为4天和11天,具有显著差异。在胸部影像学改善方面,与对照组相比,改善率分别为91.43%和62.22%。
武汉大学中南医院牵头开展了法匹拉韦治疗新冠肺炎的多中心、随机、开放、阳性平行对照临床研究,已完成各120例入组和临床治疗观察。临床研究结果显示,试验组治疗新冠肺炎的疗效显著优于对照组。在主要终点评价指标方面,普通型患者在治疗结束时的临床恢复率,试验组显著优于对照组,分别为71.43%和55.86%。在次要终点评价指标方面,试验组在退热时间上显著优于对照组,平均退热时间分别为2.5天和4.2天。试验组在咳嗽缓解时间上显著优于对照组,平均咳嗽缓解时间分别为4.57天和5.98天,普通型患者在治疗期间的辅助氧疗或无创机械通气率,试验组显著低于对照组,分别为8.16%和17.12%。以上评价指标,两组间均具有统计学的差异。
在可及性方面,今年2月国内已有企业获得国家药监局药品注册批件,并实现量产,临床药品供应有保障。

国务院联防联控机制召开发布会,介绍药物疫苗和检测试剂研发攻关最新情况。

教育部科技司司长雷
朝滋回答记者提问。

国家中医药管理局科技司司长李昱回答记者提问。

中国工程院院士王军志回答记者提问。

中国医学科学院实验动物研究所研究员秦川回答记者提问。
法匹拉韦治疗新冠肺炎4天见效 海正药业已获生产批件
国务院联防联控机制3月17日举行发布会,生物中心主任张新民介绍,法匹拉韦(法维拉韦)已完成临床研究,显示出良好临床疗效,未出现明显不良反应。
海正药业(600267)2月16日晚间公告了法匹拉韦获批的消息。2016年,海正药业获得了法匹拉韦在华的独家专利授权。获得专利的浙江海正药业,有权对法匹拉韦进行仿制药品的研发、生产、销售。
目前海正药业是唯一获批的一家。
这是疫情期间全国第一个获批上市的治疗新冠肺炎的药物。
法匹拉韦安全性好、疗效明确
有媒体报道,海正药业在2月15日通过审批后,16日凌晨就组织人员投料生产,确保以最快的速度投放市场,第一批预计产出十万片。随着产能不断扩大,法匹拉韦未来月产能或将达到一千万片。
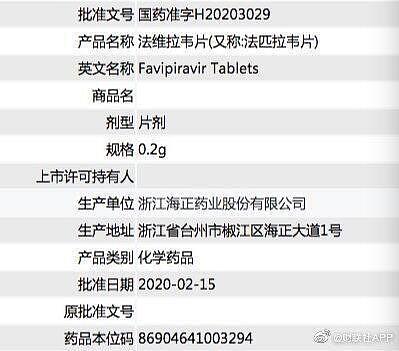
目前,还有四环制药、廊坊高博京邦制药、瑞阳制药有限公司、石药集团、中国人民解放军军事医学科学院毒物药物研究所的相关法匹拉韦产品已经提交审批。
年后,海正药业受益于疫情概念,股价上涨近8成,不过近日股价下调,今日下跌4%。
海正药业今日晚间公告,合计持股9.17%的股东国贸集团及其一致行动人英特药业,拟通过集中竞价交易方式合计减持不超过公司总股本2%的股份。
在今日发布会上,张新民称,深圳市第三人民医院开展的法匹拉韦联合干扰素治疗新冠肺炎有效性和安全性研究结果显示,在病毒核酸转阴方面,法匹拉韦治疗组治疗后患者病毒核酸转阴与对照组相比,转阴时间中位值明显缩短,分别为4天和11天,具有显著差异。在胸部影像学改善方面,与对照组相比,改善率分别为91.43%和62.22%。在治疗新冠肺炎的临床研究中,法匹拉韦未发现明显的不良反应。
简而言之,也就说用了法匹拉韦4天就见效,而且改善率超过9成,可以说此药效果绝佳。
此前,3月6日,张新民表示就表态,法匹拉韦(法维拉韦)的安全性好、疗效明确。
武汉大学中南医院牵头一项针对多中心临床研究也证实,法匹拉韦组第3天体温复常率为81.8%,对照组只有29.5%;第6天咳嗽缓解率达93.2%,对照组为 68.2%。
除了在新冠肺炎治疗上显示出不错的效果外,法匹拉韦还对多种RNA 病毒展现出良好的抗病毒作用,如埃博拉病毒、沙粒病毒、布尼亚病毒、狂犬病毒等。
日本研发
法匹拉韦是由日本富士公司研发的广谱抗病毒药物。早在2008年,转型期的富士胶片看中了正处于研究阶段的Avigan(法匹拉韦)针对流感有效性的表现,收购了富山化学,成为该药专利的实际拥有者。
2014年Avigan在日本上市用于治疗新型和复发型流感,并在对抗埃博拉病毒上名声大噪。
2016年浙江海正药业与日本富山化学工业株式会社签订了化合物专利独家授权协议,负责在中国研发、制造、销售含法匹拉韦的抗流感病毒药物,本次获批的法维拉韦片为Avigan在国内的首仿药品。
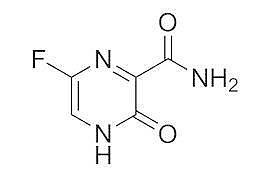
法匹拉韦结构式
2014年3月,法匹拉韦获批在日本上市,适应症为用于治疗成人新型或再次流行的流感(仅限于其它抗流感病毒药物治疗无效或效果不佳时使用)。富山化学工业株式会社于1999年8月对法匹拉韦进行了最早的化合物专利申请,期限20年,该化合物专利已于2019年8月到期。除了化合物专利外,原研公司于2008年-2016年期间还申请了中间体、组合物、制备方法、制剂、药品衍生物等外围专利,形成了较为完善的专利。
法匹拉韦在中国的表现也让日本方面重视起来,日本厚生劳动大臣加藤胜信在2月22日表示,目前还没有针对新冠肺炎患者的既定治疗方案,不过日本正在考虑使用抗流感药物法匹拉韦(Avigan)治疗新冠肺炎患者。富士胶片发言人高口弘随后表示,在日本政府要求下,富士胶片正在考虑提高该药品产量。
在没有可靠新药的情况下,国内的办法是筛选有希望的成熟药品,迅速投入到试验中。2月15日,国务院联防联控机制召开新闻发布会,提到三种药物,其中之一就是法匹拉韦。这些药品是从70000个药品核心化合物通过模拟筛选和多轮的体外实验筛选出来的,并将先后开展临床试验。不过没有提到此前备受期待的美国药品remdesivir,由全球最大的生物制药公司——美国吉利德科学公司所研发。
这些药物是针对轻型、普通型向重型转化的阻断,新冠肺炎本身就有比较高的自愈率。而针对重型、危重型患者的救治,重点推动恢复期血浆、托珠单抗、干细胞和人工肝的临床应用。
专题:武汉爆发新冠肺炎进入专题 >>
李文亮医生五周年忌,海内外网友悼念,吁言论自由(组图)
白宫:新冠病毒源自中国实验室是“可证实的事实”(图)
李文亮逝世五周年!父母痛诉:未能见最后一面(视频/组图)











 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


